
10–15x
5
min 5
min
<10
mg/l >80
mg/l
10-40
mg/l 40-80
mg/l
INVALID
RESULT
5
8
6
9
7
10
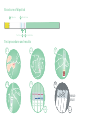
Dip area
Test line Control line
Structure of dipstick
Test procedure and results
1Result area
2
3 4

EN 3
Numbers 1 - 10 refer to illustrations on inner cover.
Structure of dipstick
1 Dip area 2 Result area 3 Test lines 4 Control line
Intended use
The Actim® CRP test is a visually interpreted, semiquantitative
immunochromatographic dipstick test, which is used for determination and
monitoring of CRP concentrations in whole blood samples. The test is intended
for professional use.
Kit components
The Actim CRP kit (31031ETAC) contains 20 CRP test packs with instructions for
use. The components of each Actim CRP test pack (31021ETAC) are:
• One dipstick in a sealed aluminum foil pouch with desiccant.
• One tube of Specimen Dilution Buffer solution (0.5 ml). The buffer contains
buffer salts, bovine serum albumin (BSA) and preservatives.
Each kit contains a vial of 10 μl end-to-end capillaries (20). Alternatively, other
10 μl capillaries or a pipette may be used for sample collection (not available
with the kit).
Lancets or lancing devices are needed if samples are taken from fingertips.
Storage
Store the test kit at +2...+25 °C. Stored unopened, each component can be used
until the expiry date marked on the component. Open the foil pouch and remove
the dipstick from the pouch just prior to use.
Specimen collection
The sample is 10 μl of whole blood diluted in Specimen Dilution Buffer. The
diluted sample can be kept at room temperature for 8 hours.
Sampling from the ngertip with the end-to-end capillary
Use a lancet or a lancing device to obtain a drop of blood from a fingertip. Take
the sample with the 10 μl capillary 5. Make sure that the capillary becomes
filled with blood. Immediately drop the capillary into the Specimen Dilution
Buffer tube. Mix the sample into the buffer by inverting the tube upside down 10-
15 times until you see that the sample has completely transferred into the buffer
(no visible whole blood in the capillary) 6.
Sampling from a whole blood sample tube
EDTA, citrate or heparin blood can also be used as a sample. The sample can be
pipetted from the blood sample tube with a 10 μl pipette. Dispense the sample
into the Specimen Dilution Buffer tube and mix the sample into the buffer.
Test procedure and interpretation of the results
1. If stored refrigerated, allow the aluminum foil pouch and the buffer tube
to reach room temperature. Open the foil pouch containing the dipstick by
tearing. Do not touch the yellow dip area at the lower part of the dipstick.
Identifying marks may be written on the upper green part of the dipstick. The
dipstick must be used shortly after its removal from the foil pouch.
2. Allow the specimen to reach room temperature before testing. Place the
yellow dip area (the lower end of the dipstick) into the diluted sample 7 and
hold it there until you see the liquid front enter the result area 8. Remove the
dipstick from the solution and place it in a horizontal position.
3. The result is available in 5 minutes 9. Do not pay attention to any lines
appearing later than 5 minutes.
If, in addition to the red control line there are
• no blue lines, the serum CRP concentration of the sample is <10 mg/l
• one blue line, the serum CRP concentration is 10-40 mg/l
• two blue lines, the serum CRP concentration is 40-80 mg/l
• three blue lines, the serum CRP concentration is >80 mg/l
If the control line does not appear, the test is invalid 10 .
The intensities of the blue lines will vary. When the CRP concentration is low
(10-15 mg/l) only one faint blue line appears in 5 minutes. As the concentration
of CRP increases, the intensity of the first line increases. A second blue line
begins to appear when the concentration exceeds 40 mg/l. Correspondingly,
for concentrations between 40 and 80 mg/l the second blue line becomes more
intense. A third blue line begins to appear when the CRP concentration exceeds
80 mg/l.
Instructions for use

4 EN
Limitations of the test
The test is intended for
in vitro
diagnostic use only.
Notes
• The test requires 150 μl of diluted sample to ensure proper performance of
the test.
• Care must be taken when placing the dipstick in the sample tube. The upper
part of the dipstick must stay dry.
• Do not use a dipstick that has become wet before use, because moisture
damages the dipstick.
• Do not use a dipstick if you notice a blue or red coloring in the result area
before testing.
• Do not use a dipstick if its aluminum foil pouch or the seals are not intact.
• When dipping, be careful to hold the dipstick in position (with the dip area in
the diluted sample) until the sample liquid front reaches the result area.
• The red control line is in the upper part of the result area. Depending on the
CRP concentration, up to three blue lines indicating different concentrations
of CRP become visible starting from the lower end of the result area.
Appearance of a control line confirms correct performance of the test.
• If a control line does not appear the test is invalid, and should be repeated
using another dipstick.
• The intensities of the test lines may vary considerably. Please note that the
second and the third line never become as intense as the first line.
• Sometimes erythrocytes may cause red coloring in the lower part of the
result area. This is normal and does not have an effect on the performance
of the test.
• If the test result cannot be interpreted clearly (e.g. if the lines are blotched or
uneven) it is recommended that the test be repeated.
• The result of a test should be interpreted only after 5 minutes have elapsed.
However, do not pay attention to any lines appearing after 5 minutes.
• As with all diagnostic tests, results must be interpreted in the light of other
clinical findings.
• All biological specimens and materials must be treated as potentially
hazardous, and disposed of in accordance with local authority guidelines.
Principle of the test
CRP is an acute-phase protein produced rapidly in response to inflammation,
infection and tissue damage. It is used in particular to differentiate bacterial
infections from virus infections. The test is based on immunochromatography.
It involves monoclonal antibodies to human CRP. One is bound to blue latex
particles (the detecting label). In the carrier membrane there are three CRP-
specific antibody zones, to which the blue latex particles will bind if the sample
contains CRP. When the dip area of the dipstick is placed in a diluted sample,
the dipstick absorbs liquid, which starts to flow up the dipstick. If the sample
contains CRP it binds to the antibody labeled with latex particles. The particles
are carried by the liquid flow and, if CRP is bound to them, they bind to the
catching antibody zones. The more CRP the sample contains the more blue lines
become visible.
The red control line confirms the correct performance of the test.
Performance of the test
Analytical sensitivity and measuring range
The lowest detection amount of CRP in serum samples is 10 mg/l. One blue
line appears when the concentration is > 10 mg/l. The second blue line appears
when serum CRP concentration is > 40 mg/l and the third line becomes visible if
the serum CRP concentration > 80 mg/l. Hook effect has been tested with CRP-
spiked samples. Samples containing up to 750 mg/l give consistently the result
> 80 mg/l. CRP test is traceable to the reference material ERM-DA470.
Repeatability and reproducibility
Intra- (repeatability) and inter- (reproducibility) assay precision studies
have confirmed that the three different cut-off values of the CRP test are
approximately 10, 40 and 80 mg/l.
Interference testing
No interferences of bilirubin, rheumatoid factor (RF), lipid and SAP (Serum
Amyloid P) have been observed.

EN 5
Diagnostic performance
Actim CRP test was evaluated at three different hospitals in Finland. At
hospitals 1 and 2 EDTA blood samples were tested against a quantitative
method. The evaluations showed that the Actim CRP results are comparable
to the quantitative measurement. Results are shown in FIG 1 and 2 on the inner
back cover. At hospital 3 Actim CRP test was performed from fingertip blood
and EDTA blood samples. The evaluation showed that the Actim CRP results are
comparable to the quantitative measurement. Results are shown in FIG 3 and 4
on the inner back cover.

6 CS
Čísla 1 – 10 se vztahují k vyobrazením uloženým uvnitř.
Struktura proužku
1 Namáčecí zóna 2 Výsledková zóna 3 Testovací linie 4 Kontrolní linie
Účel použití
Test Actim® CRP je visuálně interpretovatelný, semikvantitativní
imunochromatografický proužkový test, který je používán ke stanovení a
monitorování koncentrace CRP v plné krvi. Test je určen k profesionálnímu
použití.
Souprava obsahuje
Souprava Actim CRP (31031ETAC) obsahuje 20 CRP testů v balení s příbalovým
letákem. Komponenty každého balení testu Actim CRP (31021ETAC) jsou
následující:
• Jednotlivě balený testovací proužek v aluminiové fólii se sušidlem.
• Jednotlivé zkumavky s ředícím pufrem pro vzorek (0,5 ml). Pufr obsahuje soli,
hovězí sérový albumin (BSA) a konzervační látky.
Každá souprava obsahuje lahvičku s 10 µl kapilárami typu end-to-end (20).
Alternativně mohou být použity jiné 10 µl kapiláry nebo pipety k odběru vzorku
(které nejsou součástí testu).
Pokud se provádí odběr z prstu, jsou zapotřebí k odběru krve lancety nebo
odběrové prostředky.
Skladování
Diagnostické soupravy uchovávejte při +2…+25 °C. Každá komponenta uložená
neotevřená může být použita až do doby exspirace vyznačené na položce.
Otevřete obal a vyjměte testovací proužek těsně před použitím.
Odběr vzorku
10 µl vzorku plné krve je naředěno vzorkem ředícího pufru. Zředěný vzorek
může být uchováván při pokojové teplotě 8 hodin.
Vzorek odebraný ze špičky prstu do kapiláry typu end-to-end
Použijte kopíčko nebo odběrové zařízení k získání kapky krve ze špičky prstu.
Vzorek odeberte do 10 µl kapiláry 5. Přesvědčte se, zda došlo k naplnění
kapiláry krví. Kapiláru ihned vhoďte do ředícího pufru pro vzorek. Míchejte
vzorek s pufrem obracením zkumavky 10–15 krát nahoru a dolů, dokud
neuvidíte, že vzorek byl kompletně přenesen z kapiláry do pufru (v kapiláře není
viditelná žádná krev) 6.
Vzorek z plné krve odebrané do zkumavky
Jako vzorek může být použita krev s EDTA, citrátem nebo heparinem. Vzorek
může být pipetován ze zkumavky s krví 10 µl pipetou. Vzorek vypusťte do
ředícího pufru pro vzorek a dobře s pufrem promíchejte.
Provedení testu a interpretace výsledků
1. V případě uchovávání v chladničce nechte hliníkovou fólii a zkumavku s
pufrem ohřát na pokojovou teplotu. Otevřete natržením fólie obal obsahující
testovací proužek. Nedotýkejte se žluté ponořovací části proužku (na dolním
konci testovacího proužku). Identifikační označení může být napsáno na horní
části testovacího proužku. Testovací proužek musí být použitý krátce po
vyjmutí z ochranného obalu.
2. Před testováním ponechte vzorek vytemperovat na pokojovou teplotu.
Ponořte žlutou část proužku (dolní konec proužku) do ředícího pufru na
vzorek 7 a tam jej držte dokud neuvidíte čelo tekutiny vstupovat do
výsledkové zóny 8. Vyjměte proužek z roztoku a položte ho do horizontální
polohy.
3. Výsledek je použitelný v 5. minutě 9. Nevěnujte pozornost žádné linii, která
se objeví později než za 5 minut.
Pokud v přítomnosti červené kontrolní linie nebude
• žádná modrá linie, sérová koncentrace CRP ve vzorku je <10 mg/l;
• jedna modrá linie, sérová koncentrace CRP je 10–40 mg/l;
• dvě modré linie, sérová koncentrace je 40-80 mg/l;
• tři modré linie, sérová koncentrace je >80 mg/l;
Pokud se kontrolní linie neobjeví, test je nehodnotitelný 10 .
Intenzita modrých linií bude různá. Pokud je koncentrace CRP nízká (10–15
mg/l), objeví se do 5 minut pouze slabá modrá linie. Tak jak koncentrace CRP
vzrůstá, zesiluje se intenzita první linie. Druhá linie se začne objevovat, když
koncentrace překročí 40 mg/l. Tomu odpovídá koncentrace mezi 40 až 80 mg/l
a modrá linie se podle toho zesiluje. Třetí linie se objeví, když koncentrace CRP
překročí 80 mg/l.
Návod k použití

CS 7
Možná omezení testu
Test je určen k použití pouze jako diagnostikum
in vitro
.
Poznámky
• Test vyžaduje 150 µl ředěného vzorku k zajištění vhodného provedení testu.
• Pozornost musí být věnována tomu, když se testovací proužek vkládá do
zkumavky se vzorkem. Horní část proužku musí zůstat suchá.
• Nepoužívejte proužek, který předtím přišel do styku s vlhkostí, protože vlhkost
proužek poškozuje.
• Nepoužívejte testovací proužek, když zaznamenáte, modré nebo červené
zbarvení ve výsledkové zóně ještě před testováním.
• Nepoužívejte testovací proužek, pokud obal nebo uzávěr jsou porušené.
• Při ponořování držte testovací proužek opatrně v poloze (ponořovací částí v
naředěném vzorku) dokud se čelo tekutiny neobjeví ve výsledkové zóně.
• Kontrolní linie je v horní části nad výsledkovou linií. V závislosti na koncentraci
CRP, začínají být postupně viditelné od dolního konce výsledkové zóny tři
modré linie značící různé koncentrace. Výskyt kontrolní linie potvrzuje správné
provedení testu.
• Pokud se kontrolní linie neobjeví, test je nehodnotitelný a měl by se opakovat
použitím jiného testovacího proužku.
• Intensity testovacích linií se mohou výrazně lišit. Všiměte si, prosím, že druhá a
třetí linie se nikdy nestane tak intenzivní, jako linie první.
• Někdy mohou být erytrocyty příčinou červeného zbarvení v dolní části
výsledkové zóny. Toto je normální a nemá to vliv na výkonnost testu.
• Pokud výsledek testu nemůže být jasně interpretován (tj. linie jsou skvrnité
nebo nerovné) doporučuje se test opakovat.
• Výsledek testu by měl být interpretován pouze do uplynutí 5 minut. Jakmile se
objeví jakékoliv linie po 5 minutě, nevěnujte jim pozornost.
• Tak jako u všech diagnostických testů, musí být výsledky interpretovány ve
světle jiných klinických nálezů.
• Všechny biologické vzorky a materiály musí být považovány za potenciálně
infekční a musí být s nimi nakládáno v souladu s místními nařízeními a předpisy.
Princip testu
CRP je bílkovina akutní fáze vytvořená jako rychlá odpověď na zánět, infekci a
tkáňové poškození. Lze částečně použít k diferenciaci infekce bakteriální od
virové.
Test je založen na imunochromatografii. Ten zahrnuje monoklonální protilátky
proti lidskému CRP. Jedna je navázána na modré latexové částice (detekční).
Na nosné membráně jsou tři specifické zóny protilátek, na které jsou navázány
modré latexové částice podle koncentrace CRP. Jakmile je ponořovací část
testovacího proužku ponořena do naředěného vzorku, proužek absorbuje
tekutinu a nastartuje se vzlínání tekutiny proužkem. Pokud vzorek obsahuje
CRP, váže se na protilátkou značené latexové částice. Částice jsou unášeny
vzlínající tekutinou a pokud je na ně navázán CRP, zachytí se v zónách s
protilátkami. Čím více CRP vzorek obsahuje, tím jsou modré linie zřetelnější.
Červená kontrolní linie potvrzuje správnost provedení testu.
Funkčnost testu
Analytická citlivost a rozsah měření
Dolní mez pro detekci CRP ve vzorcích séra je 10 mg/l. Je-li koncentrace nad
10 mg/l, zobrazí se jeden modrý proužek. Druhý modrý proužek se objeví, když
sérová koncentrace CRP překročí 40 mg/l. Pokud koncentrace CRP v séru
překročí 80 mg/l, objeví se třetí proužek. Tzv. „hook effect“ byl testován pomocí
vzorků se známou koncentrací CRP. Vzorky s koncentrací více než 750 mg/l
udávaly pokaždé výsledek > 80 mg/l. Test CRP je možné najít v referenčním
materiálu ERM-DA470.
Opakovatelnost a reprodukovatelnost
Studie hodnotící přesnost testu ve smyslu opakovatelnosti a
reprodukovatelnosti potvrdily, že tři různé cut-off hodnoty (rozhodovací meze)
testu CRP jsou přibližně 10, 40 a 80 mg/l.
Testy interference
Nebyly pozorovány žádné interference s bilirubinem, revmatoidním faktorem
(RF), tuky ani se SAP (sérovým amyloidem P).

8 CS
Diagnostická funkčnost
Test Actim CRP byl hodnocen ve třech různých nemocnicích ve Finsku. V 1.
a 2. nemocnici byly srovnávány vzorky krve (EDTA) s kvantitativní metodou.
Hodnocení ukázalo, že výsledky testu Actim CRP jsou srovnatelné s
kvantitativním stanovením. Výsledky jsou uvedeny na obr. 1 a 2 na vnitřní straně
zadního krytu. Ve 3. nemocnici byl proveden test Actim CRP ze vzorků krve z
prstu a ze žíly (EDTA). Hodnocení ukázalo, že výsledky testu Actim CRP jsou
srovnatelné s kvantitativním stanovením. Výsledky jsou uvedeny na obr. 3 a 4 na
vnitřní straně zadního krytu.

DE 9
Die Nummern 1 - 10 beziehen sich auf die Abbildungen auf der inneren
Umschlagseite.
Aufbau des Teststreifens
1 Eintauchbereich 2 Testfeld 3 Positive Ergebnis-Banden 4 Kontroll-Bande
Verwendungszweck
Der Actim® CRP Test ist ein optisch interpretierbarer, semiquantitativer
immunchromatographischer Teststreifen-Test, welcher zur Bestimmung und
Überwachung von CRP Konzentrationen in Vollblut-Proben dient. Der Test ist
für den professionellen Gebrauch bestimmt.
Packungsinhalt
Die Testpackung (31031ETAC) enthält 20 CRP Testbeutel mit
Gebrauchsanweisung. Jede Actim CRP Testpackung (31021ETAC) besteht aus
folgenden Komponenten:
• Ein Teststreifen im verschlossenen Aluminiumfolienbeutel mit Trockenmittel.
• Ein Röhrchen mit Probenverdünnungspufferlösung (0,5 ml): Der
Puffer beinhaltet Puffersalz, Bovine Serum Albumin (BSA) und
Konservierungsmittel.
Jede Testpackung enthält ein Fläschchen mit 10 μl end-to-end Kapillaren (20).
Es können beliebige 10 μl Kapillaren bzw. Pipetten verwendet werden.
Lanzetten zur Blutentnahme aus der Fingerkuppe werden zusätzlich benötigt.
Lagerung und Stabilität
Die Testpackung bei +2...+25 °C lagern. Die Testkomponenten sind ungeöffnet
bis zum auf der Packung angegebenen Verfallsdatum verwendbar.
Den Folienbeutel öffnen und den Teststreifen erst vor dem Gebrauch
herausnehmen.
Probennahme
Als Probe dient 10 μl Vollblut verdünnt in Probenverdünnungspuffer. Die gelöste
Probe kann bei Raumtemperatur 8 Stunden aufbewahrt werden.
Entnahme aus der Fingerkuppe mit einer end-to-end Kapillare
Eine Lanzette benutzen, um aus der Fingerkuppe einen Bluttropfen zu erhalten.
Mit einer Kapillare die Blutprobe entnehmen 5. Sicherstellen, dass die
Kapillare vollständig mit Blut gefüllt wird. Anschließend die Kapillare sofort
in den Probenverdünnungspuffer geben. Die Probe gut mischen, indem das
Röhrchen 10-15 mal invertiert wird. Dabei muss die Probe sich vollkommen mit
dem Puffer vermischen (es darf kein Blut in der Kapillare verbleiben) 6.
Entnahme aus einem Vollblut-Probenröhrchen
Es kann EDTA-, Citrat- oder Heparinblut eingesetzt werden. Die Probe kann mit
einer 10 μl Pipette aus dem Vollblutprobenröhrchen entnommen werden, und
wird anschließend in das Probenverdünnungspufferröhrchen pipettiert und
gemischt.
Testdurchführung und Interpretation der Ergebnisse
1. Bei gekühlter Lagerung den Folienbeutel mit den Teststreifen auf
Raumtemperatur bringen. Erst dann den Beutel öffnen, dabei nicht den
gelben Bereich am unteren Ende des Teststreifens anfassen. Bei Bedarf kann
der Teststreifen auf dem grün-farbigen Teil beschriftet werden. Der dem
Folienbeutel entnommene Streifen ist sofort zu verwenden.
2. Zum Test muss die Probe Raumtemperatur haben. Den gelben Bereich
(unterer Teil des Teststreifens) in die Probe tauchen 7 und so lange warten,
bis die Flüssigkeit im Testfeld sichtbar wird 8. Danach den Teststreifen aus
der Probe nehmen und horizontal auf eine saubere Unterlage legen .
3. Das Ergebnis wird nach 5 Minuten abgelesen 9. Banden, die nach mehr als
5 Minuten auftreten, haben keine Bedeutung.
Wenn zusätzlich zu der roten Kontrollbande
• keine blaue Bande sichtbar ist, ist die Serum-CRP-Konzentration in der
Probe <10 mg/l.
• eine blaue Bande erscheint, liegt die Serum-CRP-Konzentration
bei 10-40 mg/l.
• zwei blaue Banden erscheinen, liegt die Serum-CRP-Konzentration
bei 40-80 mg/l.
• drei blaue Banden erscheinen, ist die Serum-CRP-Konzentration >80 mg/l.
Erscheint keine Kontrollbande, ist der Test ungültig 10 .
Gebrauchsanweisung

10 DE
Die Farbintensität der blauen Banden kann variieren. Bei niedriger CRP-
Konzentration (10-15 mg/l) erscheint nach 5 Minuten Reaktionszeit nur
eine schwache blaue Bande. Mit zunehmender CRP-Konzentration nimmt
die Intensität der Bande zu. Eine zweite Bande erscheint, wenn die CRP-
Konzentration 40 mg/l übersteigt. Analog nimmt mit zunehmender CRP-
Konzentration zwischen 40 und 80 mg/l die Intensität der zweiten blauen Bande
zu. Eine dritte Bande erscheint, wenn die CRP-Konzentration 80 mg/l übersteigt.
Testeinschränkungen
Der Test ist nur zur
in vitro
-Diagnostik zu verwenden.
Hinweise
• Für den Test sind etwa 150 μl verdünnte Probe erforderlich.
• Der Teststreifen muss vorsichtig in das Probenröhrchen eingeführt werden.
Flüssigkeitstropfen an den Wänden des Röhrchens dürfen die Ränder des
Teststreifens nicht befeuchten.
• Keine Teststreifen verwenden, die feucht geworden sind.
• Falls bereits eine blaue oder rote Färbung des Testfeldes vor Testbeginn
erkennbar ist, darf ein Teststreifen nicht mehr verwendet werden.
• Falls die Aluminiumfolie oder die Versiegelung der Verpackung beschädigt ist,
darf der Teststreifen nicht mehr verwendet werden.
• Den Teststreifen nur so lange in der Probe belassen, bis die Flüssigkeit vom
Testfeld aufgenommen worden ist.
• Die rote Kontrollbande liegt im oberen Teil des Testfeldes. Abhängig von
der CRP-Konzentration erscheinen, angefangen vom unteren Bereich
des Testfeldes, bis zu drei blaue Banden, die unterschiedliche CRP-
Konzentrationen anzeigen. Das Erscheinen der Kontrollbande beweist, dass
der Test einwandfrei abgelaufen ist und richtig durchgeführt wurde.
• Ist eine Kontrollbande nicht sichtbar, ist der Test nicht gültig und muss mit
einem neuen Teststreifen wiederholt werden.
• Die Intensität der Testbanden kann beträchtlich variieren. Bitte beachten
Sie, dass die zweite und die dritte Bande nie die Intensität der ersten Bande
bekommt.
• Manchmal können Erythrozyten eine rötliche Verfärbung im unteren Teil des
Ergebnisfelds hervorrufen. Das ist normal und hat keine Auswirkungen auf
die Leistung des Tests.
• Ist die Interpretation des Tests unklar (z. B. gestrichelte oder punktierte
Banden) muss der Test mit einem neuen Teststreifen wiederholt werden.
• Der Test sollte nur nach 5 Minuten ausgewertet werden. Beachten sie
allerdings keine Banden, die erst nach 5 Minuten erscheinen.
• Wie bei allen diagnostischen Tests, müssen bei der Interpretation der
Ergebnisse die anderen klinischen Befunde des Patienten berücksichtigt
werden.
• Alle biologischen Proben und Materialien sind nach Gebrauch in der für
potentiell infektiöses Material vorgeschriebenen Weise zu entsorgen.
Testprinzip
Das CRP ist ein Akute-Phase-Protein und steigt sehr rasch an bei entzündlichen
Prozessen, Infektionen und Gewebeläsionen. Die Bestimmung ist für die
Differenzierung von bakteriellen und viralen Infektionen hilfreich.
Der Test basiert auf Immunchromatographie, wobei zwei monoklonale
Antikörper gegen humanes CRP eingesetzt werden. Der erste Antikörper ist
an blaue Latexpartikel gebunden. An der Trägermembran befinden sich drei
spezifische Antikörperzonen, an welche die blauen Latexpartikel binden,
wenn CRP in der Probe vorhanden ist. Beim Eintauchen des Teststreifens
in die verdünnte Probe wird die Flüssigkeit aufgenommen und fließt in der
Membran nach oben. Enthält die Probe CRP, bindet es sich an die Latex-
fixierten Antikörper, die wiederum am Antikörperbereich der Trägermembran
festgehalten werden. Je mehr CRP in der Probe vorhanden ist, umso mehr
blaue Banden werden sichtbar.
Eine rote Bande (Kontrolle) weist nach, dass der Test einwandfrei abgelaufen ist
und richtig durchgeführt wurde.
Nachweisvermögen des Tests
Analytische Sensitivität und Messbereich
Die niedrigste nachweisbare Menge von CRP in Serumproben liegt bei 10 mg/l.
Wenn die Konzentration > 10 mg/l beträgt, erscheint eine blaue Bande. Die
zweite blaue Bande erscheint, wenn die CRP-Serumkonzentration > 40 mg/l
beträgt, und die dritte blaue Bande wird bei einer CRP-Serumkonzentration
> 80 mg/l sichtbar. Der Hook-Effekt wurde an mit CRP versetzten Proben
getestet. Proben mit bis zu 750 mg/l zeigten konsistent Ergebnisse > 80 mg/l.
Als Vergleich für den CRP-Test wurde die Referenzsubstanz ERM-DA470
verwendet.

DE 11
Wiederholbarkeit und Reproduzierbarkeit
Untersuchungen der Intraassay-Präzision (Wiederholbarkeit) und Interassay-
Präzision (Reproduzierbarkeit) haben bestätigt, dass die drei Grenzwerte des
CRP-Tests bei etwa 10, 40 und 80 mg/l liegen.
Beeinträchtigungstest
Es wurden keine Beeinträchtigungen durch Bilirubin, Rheumafaktoren (RF),
Lipide oder SAP (Serum-Amyloid P) beobachtet.
Diagnostische Leistungsfähigkeit
Der Actim-CRP-Test wurde in drei verschiedenen Krankenhäusern in
Finnland bewertet. In Krankenhaus 1 und 2 wurden EDTA-Blutproben mit
einer quantitativen Methode verglichen. Die Bewertungen ergaben, dass
die Ergebnisse des Actim-CRP-Tests vergleichbar mit den quantitativen
Messwerten sind. Die Ergebnisse sind in ABB. 1 und 2 auf der hinteren
Umschlagseite innen dargestellt. In Krankenhaus 3 wurden Actim-CRP-Tests
an Proben aus Fingerkuppenblut und EDTA-Blutproben durchgeführt. Die
Bewertung zeigte, dass die Ergebnisse des Actim-CRP-Tests vergleichbar mit
den quantitativen Messwerten sind. Die Ergebnisse sind in ABB. 3 und 4 auf der
hinteren Umschlagseite innen dargestellt.

12 ES
Los números del 1 - 10 se refieren a las ilustraciones en la cubierta interior.
Estructura de la tira
1 Area sumergible 2 Area de resultados 3 Lineas de prueba 4 Linea control
Uso recomendado
La prueba Actim® CRP se interpreta visualmente
mediante un test inmunocromatográfico semicuantitativo, el cual se usa para
la determinación y monitorización de concentraciones de PCR en muestras de
sangre total. El test es sólo para uso diagnóstico profesional.
Composición del Kit
El kit Actim CRP (31031ETAC) contiene 20 tests de PCR con instrucciones de
uso. Los componentes de cada test Actim CRP (31021ETAC) son:
• Una tira inmunocromatográfica en envase individual de aluminio sellado con
desecante.
• Un tubo de Tampón de Dilución de Muestra (0.5 ml).
El tampón contiene sales, albúmina bovina (BSA), y conservantes.
Cada kit contiene un recipiente con 20 capilares (10 μl). Alternativamente se
pueden utilizar otros capilares de 10 μl o una pipeta para la toma de muestra (no
incluida en el kit).
Para tomar una muestra por punción en el dedo, es preciso disponer de lancetas
o de un dispositivo similar para punción.
Almacenaje
Almacenar el kit a +2...+25 °C. Almacenado sin abrir, cada componente puede
utilizarse hasta la fecha de caducidad indicada en cada componente. Después
de abrir el envase de aluminio que contiene la tira, es conveniente utilizarla lo
antes posible.
Toma de Muestra
La muestra es 10 μl de sangre total diluida en el Buffer de Dilución de Muestras.
La muestra diluida se puede mantener a temperatura ambiente durante 8
horas.
Toma de muestra por punción en el dedo con los capilares
Utilizar una lanceta o dispositivo similar para obtener una gota de sangre de la
punta del dedo. Tomar la muestra con el capilar 5. Asegurarse que el capilar se
llena completamente de sangre. Inmediatamente introducir el capilar en el tubo
de Dilución de Muestra. Mezclar la muestra con el tampón invirtiendo el tubo
10-15 veces hasta que se observe que la muestra se ha transferido totalmente al
tampón (no debe observarse sangre en el interior del capilar) 6.
Toma de muestra de un tubo de sangre total
Puede utilizarse sangre con EDTA, citrato o heparinizada como muestra para
el ensayo. La muestra puede pipetearse del tubo de sangre con una pipeta
de 10 μl. Dispensar la muestra en el tubo de tampón de dilución de muestra y
mezclarla con el tampón.
Procedimiento del ensayo e interpretación de resultados
1. Si el kit se almacena refrigerado, se debe dejar que la bolsa de papel de
aluminio y el tubo de la solución tampón alcancen la temperatura ambiente.
Abrir el sobre que contiene la tira reactiva. No tocar la zona amarilla del
extremo de la tira. Los datos de identificación pueden anotarse en la zona
superior de color verde. La tira debe utilizarse tan pronto como sea posible
después de sacarla del envase de aluminio.
2. Dejar que la muestra alcance la temperature ambiente antes de realizar el
ensayo. Introducir el extremo de color amarillo de la tira (extremo inferior de
la tira) en el tubo conteniendo la muestra diluida 7 y mantenerla sumergida
hasta que se visualice en la zona de reacción la aparición del liquido 8.
Sacar la tira de la solución y dejarla sobre una superficie limpia en posición
horizontal.
3. El resultado aparece en 5 minutos 9. No prestar atención a las líneas que
aparezcan transcurridos más de 5 minutos.
Si además de la línea de color rojo,
• No aparecen ninguna línea azul, la concentración de PCR en suero de la
muestra es <10 mg/l
• Aparece una línea azul, la concentración de PCR es 10-40 mg/l
• Aparecen dos líneas azules, la concentración de PCR en suero es 40-80 mg/l
• Aparecen tres líneas azules, la concentración de PCR en suero es >80 mg/l
Si la línea de control no aparece, la prueba es inválida 10 .
Instrucciones de uso

ES 13
La intensidad de la líneas azules puede variar. Cuando la concentración de PCR es
baja (10-15 mg/l) aparecerá en 5 minutos una línea suave de color azul. A medida
que la concentración de PCR va incrementándose, la intensidad de la línea se
incrementa. Una segunda línea azul empieza a aparecer cuando la concentración
sobrepasa los 40 mg/l. Del mismo modo, para concentraciones entre 40 y 80 mg/l
la intensidad de la segunda línea azul va incrementando. La tercera línea azul
empieza a aparecer cuando la concentración de PCR sobrepasa los 80 mg/l.
Limitaciones del test
El test está diseñado para uso diagnóstico
in vitro
únicamente.
Notas
• El ensayo requiere 150 μl de muestra diluida.
• La tira debe introducirse con cuidado en el tubo de muestra. La parte superior
de la tira debe mantenerse seca.
• No utilizar una tira que haya sido humedecida anteriormente, ya que la
humedad daña la tira.
• No usar el test de prueba si encuentra color rojo o azul en el área de
resultados antes de realizar la prueba.
• No usar el test de prueba si el sobre de sellado no está intacto.
• Al introducir la tira en la muestra mantenerla en posición (con la parte
amarilla sumergida en la muestra diluida) hasta que aparezca el líquido en la
zona de reacción.
• La línea de control de color rojo aparece en la parte superior del área de
resultados. Dependiendo de la concentración de PCR, pueden aparecer,
empezando por la parte inferior del área de resultados, hasta 3 líneas de color
azul que indican diferentes concentraciones de PCR. La aparición de la línea
de control confirma el correcto funcionamiento del test.
• Si no aparece la línea de control, el test debe considerarse inválido y debe
repetirse utilizando otra tira.
• Si el test no puede interpretarse claramente (por ejemplo si las líneas
aparecen muy juntas o no se perciben bien), se recomienda repetir el test.
• Las intensidades de las líneas de prueba pueden variar considerablemente.
Tenga en cuanta que la segunda y tercera línea nunca son tan intensas como
la primera.
• Es posible que los eritrocitos causen un coloreado rojo en la parte baja del área
de resultados. Esto es normal y no tiene efecto en el rendimiento de la prueba.
• El resultado del test debe interpretarse únicamente después de 5 minutos.
La aparición de una línea azul suave transcurridos 5 minutos se tiene que
descartar.
• Como en cualquier otro test diagnóstico, los resultados deben interpretarse de
acuerdo a otras evidencias clínicas.
• Todas las muestras biológicas y materiales deben manipularse como
potencialmente peligrosos, y deben ser desechados de acuerdo a las
normativas locales vigentes.
Principio del test
La PCR es una proteína de fase aguda producida rápidamente como respuesta a
un proceso inflamatorio, infección o daño de los tejidos. Se utiliza en particular
para diferenciar las infecciones bacterianas de las infecciones víricas.
El test se basa en la técnica inmunocromatográfica. Se utilizan anticuerpos
monoclonales anti PCR humana. Uno de ellos está fijado a partículas de látex
de color azul (marcador de reacción). En la membrana hay tres zonas con
anticuerpos específicos anti PCR a las que se fijarán las partículas de látex
si la muestra contiene PCR. Cuando la tira reactiva se pone en contacto con
la muestra diluida, ésta absorbe el líquido, que comienza a difundir por la
membrana de la tira. Si la muestra contiene PCR, será capturada por los
anticuerpos fijados a las partículas de látex. Las partículas de látex difunden con
el líquido por la membrana y si la PCR se ha fijado a ellas, quedan atrapadas en
las zonas que contienen anticuerpos. Cuanta mayor cantidad de PCR contiene la
muestra, mayor número de líneas de color azul se hacen visibles.
La línea roja de control aparece siempre que el test se ha realizado correctamente.
Rendimiento del test
Sensibilidad analítica e intervalo de mediciones
La cantidad mínima detectable de CRP en las muestras de suero es de 10 mg/l.
Aparece una línea azul en concentraciones > 10 mg/l. La segunda línea azul
aparece cuando la concentración del CRP es 40 mg/l y la tercera línea se hace
visible cuando la concentración de CRP es > 80 mg/l. Se ha probado el efecto
gancho con las muestras que contienen CRP. Las muestras que contienen más
de 750 mg/l dan un coherente resultado de > 80 mg/l. La prueba de CRP se puede
encontrar en el material de referencia ERM-DA470.

14 ES
Repetibilidad y reproducibilidad
Los estudios de precisión intra- (repetitibilidad) e inter- (reproducibilidad)
han confirmado que hay tres valores límite de las pruebas de CRP que son
aproximadamente 10, 40 y 80 mg/l.
Prueba de interferencia
No se han observado interferencias entre la bilirrubina, el factor reumatoide
(RF), los lípidos y el SAP (proteína amiloide sérica).
Rendimiento diagnóstico
El test Actim CRP se ha evaluado en tres hospitales de Finlandia. En los
hospitales 1 y 2 se probaron muestras de sangre con EDTA frente a un método
cuantitativo. Las evaluaciones mostraron que los resultados de la prueba Actim
CRP son comparables a la medición cuantitativa. Los resultados se muestran en
la FIG 1 y en la FIG 2 en la cubierta trasera interior. En el 3er hospital se realizó
la prueba Actim CRP a partir de muestras de sangre digitales y de muestras de
sangre con EDTA. La evaluación mostró que los resultados de la prueba Actim
CRP son comparables a la medición cuantitativa. Los resultados se muestran
en la FIG 3 y en la FIG 4 en la cubierta trasera interior.

FI 15
Numerot 1 - 10 viittaavat sisäkannen kuviin.
Testitikun rakenne
1 Kastamisalue 2 Tulosalue 3 Testiviivat 4 Kontrolliviiva
Käyttötarkoitus
Actim® CRP -testi on visuaalisesti luettava, immunokromatografinen tikkutesti,
jota käytetään CRP-tason semikvantitatiiviseen määrittämiseen ja seurantaan
kokoverinäytteestä. Testi on tarkoitettu ammattikäyttöön.
Testipakkauksen komponentit
Testipakkaus (31031ETAC) sisältää 20 Actim CRP -testipussia ja käyttöohjeen.
Kukin Actim CRP -testipussi (31021ETAC) sisältää seuraavat komponentit:
• Yksi testitikku laminaattipussiin pakattuna kuiva-aineen kanssa.
• Yksi putki näytteenlaimennuspuskuria (0,5 ml). Liuos sisältää puskurisuoloja,
naudan seerumin albumiinia (BSA) ja säilöntäaineita.
Testipakkauksessa on lisäksi mukana näytteenottoon tarvittavia 10 µl
kapillaareja (20). Näytteenottoon voi vaihtoehtoisesti käyttää muita 10 μl
kapillaareja tai pipettejä, joita ei ole pakkauksessa mukana.
Sormenpäänäytteen ottamista varten tarvitaan lisäksi lansetteja.
Säilytys
Säilytä testipakkausta +2...+25 °C:ssä. Testin komponentit säilyvät avaamattomissa
pakkauksissa kullekin komponentille ilmoitettuun viimeiseen käyttöpäivään
saakka. Avaa alumiinipussi ja poista tikku pussista juuri ennen käyttöä.
Näytteen ottaminen
Näytteenä käytetään 10 μl kokoverta, joka on laimennettu näytteenlaimennus-
puskuriin. Laimennettua näytettä voidaan säilyttää 8 tuntia huoneenlämmössä.
Sormenpääverinäytteen ottaminen
Käytä lansettia verinäytteen ottamiseksi sormenpäästä. Ota näyte kapillaariin
varmistaen, että koko kapillaari täyttyy verellä
5
. Tiputa kapillaari
välittömästi näytteenlaimennuspuskuriputkeen. Sekoita näyte puskuriin
kääntelemällä putkea ylösalaisin 10-15 kertaa, kunnes näet näytteen siirtyneen
kokonaisuudessaan puskuriin (kapillaarissa ei ole jäljellä näkyvää kokoverta)
6
.
Näytteen ottaminen kokoveriputkesta
Näytteenä voi käyttää myös EDTA-, sitraatti- tai hepariiniverta. Näyte
voidaan pipetoida näyteputkesta 10 μl pipetillä. Annostele näyte
näytteenlaimennuspuskuriputkeen ja sekoita se puskuriin.
Testin suoritus ja tulosten tulkinta
1. Jos testipakkausta säilytetään jääkaapissa, anna alumiinifoliopussin
ja puskuriputken lämmetä huoneenlämpöiseksi. Avaa laminaattipussi
repäisemällä. Älä koske testitikun alaosassa olevaan keltaiseen
kastamisalueeseen. Näytemerkinnät voi tarvittaessa kirjoittaa testitikun
vihreään osaan. Laminaattipussista poistettu testitikku on käytettävä
viipymättä.
2. Testattaessa näytteen tulee olla huoneenlämpöinen. Aseta keltainen
kastamisalue (testitikun alaosa) näytteeseen 7 ja pidä tikkua paikallaan,
kunnes nesterintama alkaa näkyä tulosalueella 8. Nosta testitikku pois
näytteestä ja aseta se puhtaalle alustalle vaakasuoraan asentoon.
3. Testitulos luetaan 5 minuutin kohdalla 9. Älä kiinnitä huomiota viivoihin,
jotka ilmestyvät 5 minuutin jälkeen.
Jos punaisen kontrolliviivan lisäksi tulosalueella
• ei ole yhtään sinistä viivaa, potilaan seerumin CRP-pitoisuus on <10 mg/l
• on yksi sininen viiva, potilaan seerumin CRP-pitoisuus on 10-40 mg/l
• on kaksi sinistä viivaa, potilaan seerumin CRP-pitoisuus on 40-80 mg/l
• on kolme sinistä viivaa, potilaan seerumin CRP-pitoisuus on >80 mg/l
Jos kontrolliviiva ei ilmesty, testin tulos on mitätön 10 .
Sinisten viivojen intensiteetit vaihtelevat. Jos CRP-pitoisuus on matala (10-15
mg/l), vain yksi heikko sininen viiva ilmestyy 5 minuutissa. Ensimmäisen viivan
intensitetti voimistuu kun CRP-pitoisuus on korkeampi. Toinen sininen viiva
alkaa ilmestyä, kun CRP-pitoisuus ylittää 40 mg/l. Vastaavasti pitoisuuden
ollessa välillä 40-80 mg/l, toinen sininen viiva vahvistuu. Kolmas sininen viiva
alkaa ilmestyä kun pitoisuus ylittää 80 mg/l.
Käyttöohje

16 FI
Testin rajoitukset
Testi on tarkoitettu vain
in vitro
-diagnostiseen käyttöön.
Huomautuksia
• Testin suoritus vaatii noin 150 μl laimennettua näytettä.
• Testitikku on asetettava näyteputkeen huolellisesti siten, että putken
seinämissä mahdollisesti olevat nestepisarat eivät kastele testitikun reunoja.
• Älä käytä testitikkua, joka on kastunut, sillä kosteus vahingoittaa tikkua.
• Älä käytä testitikkua, jossa tulosalueella näkyy sinistä tai punaista jo ennen
testin suorittamista.
• Älä käytä testitikkua, jos sen alumiinipakkaus on vahingoittunut tai saumat
eivät ole kiinni.
• Testitikkua on pidettävä näytteessä niin kauan, että neste ehtii imeytyä
tulosalueelle asti.
• Punainen kontrolliviiva on tulosalueen yläosassa. CRP-pitoisuudesta riippuen
tulosalueelle ilmestyy enintään kolme sinistä viivaa tulosalueen alareunasta
alkaen. Kontrolliviivan ilmestyminen varmistaa testin oikean suorituksen.
• Jos kontrolliviiva ei ilmesty, testi on mitätön ja tulisi uusia uudella testitikulla.
• Testiviivojen intensiteetit voivat vaihdella merkittävästi. Huomatkaa, että
toinen ja kolmas testiviiva ei koskaan tule yhtä vahvoiksi kuin ensimmäinen
testiviiva.
• Joskus punasolut voivat aiheuttaa punaista värjäytymistä tulosalueen
alareunaan. Tämä on normaalia, eikä sillä ole vaikutusta testin toimintaan.
• Mikäli tuloksen tulkinta on epäselvä (esimerkiksi epäyhtenäiset tai
pistemäiset viivat) suosittelemme testin uusimista.
• Testin tulos tulee tulkita 5 minuutin kuluttua. Mahdollisiin 5 minuutin jälkeen
ilmestyviin viivoihin ei tule kiinnittää huomiota.
• Tuloksia tulkitessa tulee ottaa huomioon potilaan muut kliiniset tiedot.
• Kaikkia biologisia näytteitä ja materiaaleja on pidettävä mahdollisesti
tartuntavaarallisina ja ne on hävitettävä paikallisten määräysten mukaan.
Testin periaate
CRP on akuuttifaasiproteiini, jonka pitoisuus veressä kohoaa nopeasti ja
voimakkaasti mm. kudostuhon, tulehduksen ja infektion seurauksena. Sitä
käytetään erityisesti erottamaan bakteeri-infektiot virusten aiheuttamista
infektioista.
Testi perustuu immunokromatografiaan. Siinä käytetään CRP:lle
spesifisiä monoklonaalisia vasta-aineita. Vasta-ainetta on sidottu sinisiin
lateksipartikkeleihin (leima). Tulosalueella on kolme CRP:lle spesifistä vasta-
ainevyöhykettä, johon siniset lateksipartikkelit tarttuvat, mikäli näyte sisältää
CRP:tä. Kun testitikun kastamisalue kastetaan laimennettuun verinäytteeseen,
neste imeytyy tikkuun ja liikkuu sitä pitkin ylöspäin. Näytteessä mahdollisesti
oleva CRP sitoutuu lateksipartikkeleihin kiinnitettyyn vasta-aineeseen.
Lateksipartikkelit kulkevat nestevirran mukana, ja mikäli niihin on kiinnittynyt
CRP:tä, ne tarttuvat kantajamembraanissa oleviin vasta-ainevyöhykkeisiin. Mitä
enemmän näytteessä on CRP:tä sitä useampi sininen viiva muodostuu.
Punainen kontrolliviiva muodostuu aina, kun testi on suoritettu oikein.
Testin suorituskyky
Analyysiherkkyys ja mittausalue
Pienin todettava CRP:n pitoisuus seeruminäytteestä on 10 mg/l. Yksi
sininen viiva näkyy, kun pitoisuus on yli 10 mg/l. Kaksi sinistä viivaa näkyy,
kun seerumin CRP-pitoisuus ylittää 40 mg/l ja kolme viivaa, kun seerumin
CRP-pitoisuus on suurempi kuin 80 mg/l. Hook-efekti on testattu korkeilla
CRP-näytteillä. Näytteet, joiden pitoisuus on enintään 750 mg/l, antoivat
johdonmukaisesti tuloksen > 80 mg/l. CRP-testi on jäljitettävissä ERM-DA470-
referenssimateriaaliin.
Toistettavuus ja uusittavuus
Mittaussarjan sisäisillä (toistettavuus) ja sarjojen välisillä (uusittavuus)
tarkkuuden tutkimuksilla CRP-testin kolmeksi toteamisrajaksi on vahvistettu
10, 40 ja 80 mg/l.
Häiriöalttiuden testaus
Bilirubiinin, reumatekijän (RF), lipidin tai seerumin amyloidi-P-komponentin
(SAP) ei todettu aiheuttavan häiriöitä.

FI 17
Diagnostinen suorituskyky
Actim CRP -testiä arvioitiin kolmessa suomalaisessa sairaalassa. Sairaaloissa
1 ja 2 EDTA-verinäytteitä testattiin ja verrattiin kvantitatiiviseen menetelmään.
Arvioinnit osoittivat, että Actim CRP -testin tulokset olivat vertailukelpoisia
kvantitatiivisen mittauksen tulosten kanssa. Tulokset on esitetty
sisätakakannen kuvissa 1 ja 2. Sairaalassa 3 Actim CRP -testissä käytettiin
sormenpään ja EDTA-verinäytteitä. Arviointi osoitti, että Actim CRP -testin
tulokset olivat vertailukelpoisia kvantitatiivisen mittauksen tulosten kanssa.
Tulokset on esitetty sisätakakannen kuvissa 3 ja 4.

18 FR
Les numéros 1 - 10 se réfèrent aux images d’illustration de la couverture
interne.
Structure de la bandelette
1 Zone d’immersion 2 Zone de résultats 3 Lignes-Test 4 Ligne-Contrôle
But du test
Actim® CRP Test est un test immunochromatographique d’interprétation
visuelle, semi-quantitatif pour la détermination et le suivi des concentrations en
CRP dans les échantillons de sang total. Le test est à usage professionnel.
Composition du coret
Le coffret Actim CRP (31031ETAC) contient 20 sachets de tests avec notices
d’utilisation. Les composants de chaque sachet d’Actim CRP (31021ETAC) sont:
• Une bandelette dans un sachet fermé en aluminium avec un dessicant.
• Un tube de tampon de dilution (0,5 ml). Le tampon contient des sels, de la
sérum albumine bovine (BSA) et des conservateurs.
Chaque coffret contient un flacon de capillaires de 10 µl (20). Tout capillaire
de 10 μl ou pipette (non disponible dans le coffret) peut être utilisé pour le
prélèvement des échantillons.
Des lancettes sont nécessaires si les échantillons sont prélevés au bout des
doigts.
Conservation
Conserver le coffret à +2…+25 °C. Ne pas dépasser la date de péremption
indiquée sur l’étiquette. Ouvrir le sachet et sortir la bandelette du sachet juste
au moment de l’utilisation.
Recueil de l’échantillon
L’échantillon correspond à 10 μl de sang total dilué dans le tampon de dilution.
L’échantillon dilué peut être conservé à température ambiante pendant 8
heures.
Prélèvement au bout du doigt avec le capillaire
Utiliser une lancette pour obtenir une goutte de sang au bout du doigt. Prélever
l’échantillon avec le capillaire 5. S’assurer que le capillaire est rempli de sang.
Introduire immédiatement le capillaire dans le tube de tampon de dilution.
Mélanger l’échantillon dans le tampon en retournant le tube 10-15 fois jusqu’à
ce que l’échantillon soit complètement mélangé au tampon (plus de traces de
sang visibles dans le capillaire) 6.
Prélèvement depuis un tube de sang total
Les échantillons recueillis sur EDTA, citrate ou héparine peuvent être utilisés.
L’échantillon peut être prélevé depuis un tube de sang total avec une pipette de
10 μl. Verser l’échantillon dans le tube de tampon de dilution et mélanger.
Mode d’emploi et interprétation des résultats
1. En cas de conservation au réfrigérateur, laisser le sachet en aluminium et le
tube de solution tampon revenir à température ambiante. Ouvrir l’emballage
en aluminium contenant la bandelette, du côté indiqué. Ne pas toucher la
zone absorbante jaune située à l’extrémité inférieure de la bandelette. Des
marques d’identification peuvent être écrites sur la partie supérieure verte
de la bandelette. Utiliser la bandelette rapidement après l’avoir retirée du
sachet.
2. Avant de réaliser le test, laisser l’extrait d’échantillon revenir à température
ambiante. Placer la zone absorbante jaune dans l’échantillon dilué 7 et
maintenir à ce niveau jusqu’à ce que le front de migration atteigne la zone de
résultats 8. Enlever la bandelette de la solution et placer la à l’horizontal.
3. Le résultat se lit en 5 minutes 9. Toute ligne apparaissant au-delà de 5
minutes ne doit pas être prise en considération.
Si, en plus de la ligne-contrôle rouge, il y a:
• aucune autre ligne bleue, la concentration du sérum en CRP est <10 mg/l
• une ligne bleue, la concentration du sérum en CRP est 10-40 mg/l
• 2 lignes bleues, la concentration du sérum en CRP est 40-80 mg/l
• 3 lignes bleues, la concentration du sérum en CRP est >80 mg/l
Si la ligne de contrôle n’apparaît pas, le test est invalide 10 .
L’intensité des lignes bleues varie. Quand la concentration en CRP est faible (10-
15 mg/l), une pâle ligne bleue apparaît en 5 minutes. Lorsque la concentration
en CRP augmente, l’intensité de la ligne augmente également. Une deuxième
Notice d’utilisation

FR 19
ligne bleue commence à apparaître quand la concentration excède 40 mg/l.
Ainsi, pour des concentrations entre 40 et 80 mg/l, la deuxième ligne bleue
devient plus intense. Une troisième ligne bleue commence à apparaître quand la
concentration en CRP excède 80 mg/l.
Limites du test
Pour usage
in vitro
uniquement.
Remarques
• Le test nécessite 150 μl d’échantillon dilué pour assurer la réalisation
convenable de la réaction.
• L’introduction de la bandelette dans le tube de dilution doit se faire avec
précaution. La partie supérieure doit rester sèche.
• Ne pas utiliser une bandelette préalablement exposée à l’humidité (celle-ci
endommage l’intégrité de la bandelette).
• Ne pas utiliser une bandelette présentant une coloration bleue ou rouge dans
la zone de résultats.
• Ne pas utiliser une bandelette si le sachet la contenant n’est pas intact.
• Lors de l’immersion, il est important de tenir la bandelette dans la bonne
position pour que le front de migration atteigne la zone de résultats.
• La ligne-contrôle rouge est située dans la partie supérieure de la zone
de résultats. Selon la concentration en CRP, jusqu’à trois lignes bleues,
indiquant des concentrations différentes en CRP, deviennent visibles à partir
de la partie inférieure de la zone de résultats. L’apparition d’une ligne-
contrôle valide le test. Si une ligne contrôle n’apparaît pas, le test est invalide
et doit être répété avec une nouvelle bandelette.
• Les intensités des lignes tests peuvent varier considérablement. A noter que
la seconde et la troisième ligne ne deviennent jamais aussi intenses que la
première ligne test.
• Parfois des globules rouges peuvent colorer la partie inférieure de la zone de
résultat. Ceci est normal et n’affecte pas la performance du test.
• Si le test ne peut être interprété correctement (par exemple si les lignes sont
marbrées ou irrégulières), il est recommandé de répéter le test avec une
nouvelle bandelette.
• Le résultat du test doit être interprété à 5 minutes. Ne pas tenir compte de
ligne apparaissant après 5 minutes.
• Comme tous les résultats de diagnostic, les résultats doivent être interprétés
en fonction de l’ensemble des données cliniques avant d’établir un diagnostic
final.
• Tout échantillon et matériel biologique doit être considéré comme
potentiellement infectieux, manipulé avec précaution et éliminé selon les
recommandations en vigueur.
Principe du test
CRP est une protéine caractéristique d’une phase aiguë, produite rapidement
en réponse à une inflammation, une infection ou une lésion des tissus. Elle est
utilisée en particulier pour différencier une infection bactérienne d’une infection
virale.
Actim CRP est un test immunochromatographique qui utilise des anticorps
monoclonaux dirigés contre la CRP humaine. Ces anticorps anti-CRP, fixés aux
particules de latex bleues forment des complexes immuns en présence de CRP.
Lorsque la zone absorbante de la bandelette est introduite dans l’échantillon
dilué, la CRP, si elle est présente, se lie à l’anticorps fixé sur les particules de
latex et migre le long de la membrane. La CRP est ensuite capturée au niveau
de la ligne contenant le second anticorps. Au cours de leur migration sur la
membrane, ces complexes se fixent sur trois zones d’anticorps spécifiques de
la CRP.
Plus le taux de CRP dans l’échantillon augmente, plus le nombre de lignes
bleues visible augmente.
La ligne rouge (ligne-contrôle) valide le test.
Performances du test
Sensibilité de l’analyse et plage de mesure
Le volume de détection le plus bas de CRP dans les échantillons de sérum est
de 10 mg/l. Une ligne bleue apparaît lorsque la concentration est >10 mg/l. La
deuxième ligne bleue apparaît lorsque la concentration de CRP dans le sérum
est >40 mg/l et la troisième ligne devient visible si la concentration de CRP dans
le sérum >80 mg/l. L’effet crochet a été testé avec des échantillons additionnés
de CRP. Les échantillons contenant jusqu’à 750 mg/l fournissent un résultat
constamment >80 mg/l. Le test CRP est rattachable au document de référence
ERM-DA470.

20 FR
Répétabilité et reproductibilité
Des études de précision de la répétabilité intradosage et de la reproductibilité
interdosage ont confirmé que trois valeurs différentes de seuil de détection du
test CRP sont approximativement les suivantes : 10, 40 et 80 mg/l.
Test d’interférence
Aucune interférence de bilirubine, facteur rhumatoïde (FR), lipide et SAP
(Serum Amyloid P) n’a été observée.
Performances diagnostiques
Le test Actim CRP a été évalué dans trois hôpitaux différents en Finlande. Dans
les hôpitaux 1 et 2, des échantillons de sang EDTA ont été testés selon une
méthode quantitative. Ces évaluations ont montré que les résultats Actim CRP
sont comparables à la mesure quantitative. Les résultats sont présentés aux
FIG 1 et 2 en dos de couverture interne. Dans l’hôpital 3, un test Actim CRP a
été réalisé à partir d’échantillons issus d’un prélèvement sanguin au bout du
doigt et de sang EDTA. L’évaluation a montré que les résultats Actim CRP sont
comparables à la mesure quantitative. Les résultats sont présentés aux FIG 3 et
4 en dos de couverture interne.
Sidan laddas...
Sidan laddas...
Sidan laddas...
Sidan laddas...
Sidan laddas...
Sidan laddas...
Sidan laddas...
Sidan laddas...
Sidan laddas...
Sidan laddas...
Sidan laddas...
Sidan laddas...
Sidan laddas...
Sidan laddas...
Sidan laddas...
Sidan laddas...
Sidan laddas...
Sidan laddas...
-
 1
1
-
 2
2
-
 3
3
-
 4
4
-
 5
5
-
 6
6
-
 7
7
-
 8
8
-
 9
9
-
 10
10
-
 11
11
-
 12
12
-
 13
13
-
 14
14
-
 15
15
-
 16
16
-
 17
17
-
 18
18
-
 19
19
-
 20
20
-
 21
21
-
 22
22
-
 23
23
-
 24
24
-
 25
25
-
 26
26
-
 27
27
-
 28
28
-
 29
29
-
 30
30
-
 31
31
-
 32
32
-
 33
33
-
 34
34
-
 35
35
-
 36
36
-
 37
37
-
 38
38
på andra språk
- italiano: PRAXISDIENST Actim Manuale utente
- español: PRAXISDIENST Actim Manual de usuario
- Deutsch: PRAXISDIENST Actim Benutzerhandbuch
- polski: PRAXISDIENST Actim Instrukcja obsługi
- français: PRAXISDIENST Actim Manuel utilisateur
- English: PRAXISDIENST Actim User manual
- dansk: PRAXISDIENST Actim Brugermanual
Relaterade papper
Andra dokument
-
NAL 252017N-05 Användarmanual
-
NAL 252017N-05 Användarmanual
-
cerascreen 99090824 Användarmanual
-
Waeco COOLMATIC CRP 40 Bruksanvisning
-
Waeco CoolMatic CRP-40 Bruksanvisningar
-
Denver CRP-717WHITE Användarmanual
-
Denver CRP-515 Användarmanual
-
3M Allergen Protein Rapid Kit Bruksanvisningar
-
 nal von minden 252017N-05 Användarmanual
nal von minden 252017N-05 Användarmanual
-
NAL NADAL Troponin I Test Användarmanual








































